
钍基核裂变能全国重点实验室 |
|||
|
-钍基核能物理中心-
|
|||
熔盐机械工程技术部 |
|||
仪控工程技术部 |
|||
熔盐化学工程技术部 |
|||
|
-核能综合利用研究中心-
|
|||
材料研究部 |
|||
钍铀循环化学部 |
|||
应用化学技术部 |
|||
氚科学与工程技术部 |
|||
核与辐射安全技术部 |
|||
应用加速器技术部 |
|||
反应堆运行技术部 |



2012年5月21日,清华大学医学院颜宁教授研究组及其合作者在Nature在线发表了名为《Crystal structure of an orthologue of the NaChBac voltage-gated sodium channel》的科研论文,报道了电压门控钠离子通道细菌同源蛋白NavRh的晶体结构,并对其功能性质和工作机理进行了研究。这是第一次解析出处于灭活构象的电压门控离子通道的结构,也是第一次发现钠离子通道中的抑制离子结合位点。
电压门控钠离子通道(Voltage gated sodium channel)广泛存在于人体中,能够引起可激活细胞的动作电位,在神经兴奋与传导、中枢神经系统的调控、心脏搏动、平滑肌蠕动和骨骼肌收缩等过程中都具有重要功能,是人体电信号传导过程的必需蛋白。电压门控钠离子通道的功能缺陷将会引发严重的疾病,如高血钾周期性麻痹、强直性肌痉挛症和心律不齐等,因而钠离子通道是重要的药物靶点。在国际上对于电压门控钠离子通道的功能研究已有60余年。相比于钾离子通道的结构生物学研究进展,钠离子通道的结构生物学研究,由于技术上的巨大难度,进展十分缓慢。2001年发现了电压门控钠离子通道的细菌同源蛋白,从而为解析钠离子通道的结构提供了可能。十多年来全世界许多结构生物学实验室都将这项课题作为攻关项目。
经过多年的不懈努力,颜宁教授领导的研究团队利用上海光源生物大分子晶体学线站(BL17U1)解析了电压门控钠离子通道NavRh的三维晶体结构,首次从结构的角度报道了抑制离子钙离子在电压门控钠离子通道的结合位点,也是首次获得处于灭活构象的电压门控离子通道。通过与另一电压门控钠离子通道NavAb的结构比对,颜宁研究组首次根据三维晶体结构模拟了通道中门控电荷(gating charges)的转移过程。这项工作不但为真核电压门控钠离子通道功能的进一步研究提供有力的结构依据,而且为该领域存在的重大争议问题提供结构线索。此外,相对高性价比的纯化和结晶方法,使得NavRh可以用来进行以结构为基础的药物设计和药物筛选。
这项研究由颜宁研究组与哈佛大学David Clapham教授、洛克菲勒大学Roderick Mackinnon教授(2003年诺贝尔奖获得者)以及上海光源生物大分子晶体学研究组等合作完成。
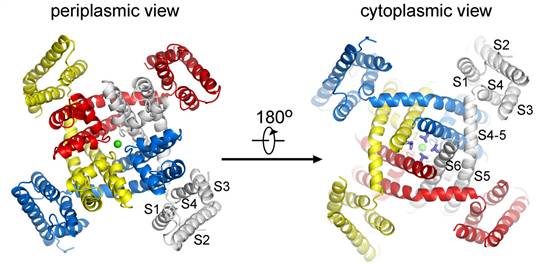
电压门控钠离子通道NavRh的整体结构是由四个亚基组成的空间上不完全对称的四聚体。通道中心为孔道结构域,四周围绕的是电压感应结构域。